| ||||||||
|
Pesquisadores do Laboratório de Oncologia Molecular da Faculdade de Ciências Médicas (FCM) da Unicamp testaram com sucesso uma nova via bioquímica para o tratamento do câncer. O estudo associou a metformina, o principal medicamento utilizado no tratamento do diabetes tipo 2, ao quimioterápico paclitaxel, droga utilizada em pacientes com câncer de mama e pulmão. Nos estudos realizados in vitro e em cobaias, os pesquisadores conseguiram inibir o crescimento do tumor. Esta associação representa um avanço na terapia-alvo e surge como nova linha de tratamento para os pacientes com câncer.
A estreita relação entre a obesidade e o câncer vem sendo confirmada por meio de estudos, pesquisas e análises em todo o mundo. O Instituto Nacional de Câncer (Inca) classifica o excesso de peso como o segundo maior fator de risco evitável para a doença. Segundo a União Internacional de Controle do Câncer, obesidade e sedentarismo são os principais fatores de risco para cerca de 30% dos casos da doença. O mecanismo de como isto acontece merece atenção de pesquisadores do mundo todo. No caso do diabetes, a relação é a mesma. Indivíduos com sobrepeso ou obesidade têm três vezes mais risco de desenvolverem diabetes do que uma pessoa considerada com peso normal. Para o tratamento do diabetes tipo 2, a droga mais utilizada no mundo é a metformina. A metformina é um medicamento oral derivado da guanidina, o composto ativo originário da Galega officinalis, erva medicinal também conhecida como Lilac e usada por séculos na Europa como tratamento do diabetes desde a Idade Média. A metformina reduz a ocorrência de todas as complicações do diabetes e também pode reduzir discretamente os níveis de LDL, conhecido como colesteraol ruim, e de triglicérides. “Na busca de um mecanismo comum para a origem da obesidade e do câncer e com o conhecimento prévio de que a metformina, ao entrar na célula, levava à ativação de uma proteína-chave que regula a proliferação celular, procuramos por quimioterápicos cujo efeito atuasse nesta mesma proteína. E achamos um que fazia isto. A ideia foi associar as drogas e o resultado que encontramos foi surpreendente”, disse . José Barreto Campello Caravalheira. Quimioterapia moderna Dentre os muitos desafios da medicina, nenhum teve início mais controverso do que o tratamento do câncer. O início da era moderna da quimioterapia pode ser vinculado diretamente à descoberta do gás mostarda. Em 1942, Louis Goodman e Alfred Gilman, ambos farmacologistas, trataram um paciente portador de linfoma não-Hodgkin com o gás mostarda baseado em achados da autópsia de soldados que morreram na I Guerra Mundial. Uma segunda abordagem para o tratamento do câncer teve início logo após a Segunda Guerra, quando Sydney Farber, um patologista da escola de medicina da Harvard, investigou o efeito do ácido fólico em pacientes com leucemia. A partir de 1950, outras drogas antileucêmicas foram estudadas e iniciou-se a era da quimioterapia com ensaios in vivo para inibição da síntese de DNA. Sinalização celular A complexidade do desenvolvimento e crescimento de organismos pode ser atribuída às interações dinâmicas e diversas entre hormônios, fatores de crescimento, contatos entre as células e outros estímulos externos que coordenam o destino de cada célula através de seus receptores de membrana. A explosão da pesquisa em transmissão do sinal intracelular nos últimos dez anos vem decifrando os mecanismos básicos de sinalização intracelular de um grande número desses receptores de membrana. Um dos mais interessantes aspectos da transmissão do sinal intracelular descoberto nos últimos cinco anos é a constatação de que muitas vias de sinalização com diversas ações podem interagir em múltiplos níveis – isto é frequentemente chamado de crosstalk. A elucidação das vias de crescimento celular e a observação de que essas vias estão alteradas no câncer humano levou a procura de inibidores específicos. A célula é um dos menores organismos vivos. Além da membrana plasmática, núcleo, ribossomos, complexo de Golgi, mitocôndrias, cromossomo e DNA, 10% dela é constituída de proteínas, enzimas e outras estruturas. Uma das características mais comuns das células cancerígenas é o seu ritmo rápido de divisão celular, conhecida na biologia como mitose. A fim de acomodar isto, a célula está em constante reestruturação. Flexibilidade é a chave. Em sua dissertação de mestrado, Guilherme Zweig Rocha descreve o funcionamento do paclitaxel e os caminhos de sua ação na célula. Três proteínas participam deste processo. A proteína p53 é citoplasmática e sintetizada pela própria célula responsável por ativar a maquinaria de reparo do DNA. A AMPK, sigla de proteína quinase ativada por AMP, é uma proteína que exerce efeitos sobre o metabolismo da glicose e dos lipídios. A AMPK é como um sensor energético e pode ser denominada de proteína-chave da célula. A mTOR é a proteína responsável pelo crescimento celular, tanto de células sadias quanto cancerosas. O paclitaxel entra na célula e se liga a microtúbulos impedindo a separação dos cromossomos duplicados e a divisão das duas células filhas. Uma vez que o número de cromossomos nas células está incorreto, a proteína p53 é ativada para que a correção seja feita. A proteína p53 é responsável por “verificar” a integridade do material genético da célula. Se este material não estiver da forma correta, a p53 é que ativa a maquinaria de reparo. Se não for possível reparar o dano, a p53 também dá início ao processo de apoptose, ou seja, a morte da célula. “A ativação de p53 leva ao aumento de proteínas chamadas sestrinas. As sestrinas ativadas pelo estresse genotóxico causam, por sua vez, a ativação da proteína AMPK. Essa ativação leva a inibição da mTOR, responsável pelo crescimento do tumor. A via de sinalização AMPK/ mTOR parece ser um bom alvo para o bloqueio de crescimento e morte de células tumorais”, explicou Rocha. Ao perceberem que tanto o paclitaxel quanto a metformina atuavam na AMPK isoladamente, tanto na quimioterapia quanto no tratamento do diabetes, os pesquisadores resolveram associar os dois medicamentos para o tratamento do câncer de mama e pulmão. De acordo com os resultados do estudo, a combinação entre metfotmina e paclitaxel tem efeito antitumoral capaz de induzir a interrupção do ciclo celular do tumor cancerígeno. O tratamento combinado das duas drogas, descrevem, potencializa a ativação da AMPK e leva a uma redução drástica de sinalização molecular através da mTOR, o que diminui a proliferação celular. “Ao invés de tentarmos inibir a mTOR no final do processo do desenvolvimento do tumor, achamos melhor dar um passo atrás e potencializarmos a ativação da proteína AMPK”, explicou Caravalheira. Primeiramente, as células de câncer de mama e de pulmão foram tratadas com metformina e com paclitaxel em testes in vitro. Depois, foram inoculadas em camundongos com a capacidade de permitir que células humanas crescessem neles. Os animais foram tratados com metformina ou paclitaxel separadamente ou com a combinação das duas drogas. De acordo com a pesquisa, os animais controle, isto é, sem tratamento, tiveram o tumor aproximadamente cinco vezes maior que os animais com tratamento associado. Nos animais tratados apenas com paclitaxel, o tumor ficou o dobro do tamanho. No tratamento com metformina, alcançou quase o triplo. “Observamos que o tratamento de metformina com paclitaxel resulta na parada do ciclo celular na fase anterior à mitose e diminui o crescimento tumoral em animais em relação aos tratamentos isolados e ao grupo controle. Assim, podemos sugerir que a associação das duas drogas potencializa a ativação da AMPK e leva a uma diminuição da atividade de vias de crescimento, proliferação e diferenciação celular. Esta pode ser uma alternativa mais eficiente para o tratamento do câncer”, explicou Rocha. Segundo Carvalheira, em oncologia, as coisas não são passadas de uma fase de laboratório para pacientes com tanta facilidade. Entretanto, por meio da aprovação do Comitê de Ética em Pesquisa e pelos resultados promissores obtidos nos estudos, pacientes com câncer de cabeça e pescoço atendidos no ambulatório de Oncologia do Hospital de Clínicas (HC) da Unicamp e no Hospital do Câncer de Barretos, interior de São Paulo, já estão sendo recrutados para o tratamento com esta nova combinação de medicamentos. A escolha desse tipo de paciente é por causa da facilidade em se conseguir a biópsia do tumor e analisar o processo bioquímico à luz da descrição científica de todo a pesquisa. “A proteína AMPK é um alvo para o tratamento. É isto que sugerimos no artigo. Nós conseguimos parar o crescimento do tumor. Temos fé nesta nova combinação terapêutica”, disse Carvalheira. Além de Rocha e Carvalheira, o artigo publicado na Clinical Cancer Research teve a colaboração de Marília M. Dias, Eduardo R. Ropelle, Felipe Osório-Costa, Mario José Abdalla Saad, da área de medicina interna do Departamento de Clínica de Médica, e Franco A. Rossato e Aníbal E. Vercesi, do Departamento de Patologia Clínica, ambos da FCM. A pesquisa teve apoio da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) e do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). ................................................ Rocha GZ, Dias MM, Ropelle ER, Osório-Costa F, Rossato FA, Vercesi AE, Saad MJA, Carvalheira JBC. Metformin amplifies chemotherapy-induced AMPK activation and antitumoral growth. Clinical Cancer Reaserch, 2011. | ||||||||

 Isto foi possível devido ao “insight” dos pesquisadores em perceber a lógica bioquímica que existe por trás de ambas as doenças, que têm uma causa comum para cerca de 30% dos casos de câncer registrados no mundo: a obesidade. A pesquisa está sendo publicada na revista norte-americana Clinical Cancer Research e teve como base a dissertação de mestrado “Efeito do paclitaxel na via IRS/PI3K/ Akt/mTOR em linhagem de adenocarcinoma de mama e carcinoma de pulmão”, defendida no ano passado no programa de pós-graduação em fisiopatologia médica da FCM pelo biólogo Guilherme Zweig Rocha. A orientação do trabalho foi do professor do Departamento de Clínica Médica e médico oncologista José Barreto Campello Carvalheira.
Isto foi possível devido ao “insight” dos pesquisadores em perceber a lógica bioquímica que existe por trás de ambas as doenças, que têm uma causa comum para cerca de 30% dos casos de câncer registrados no mundo: a obesidade. A pesquisa está sendo publicada na revista norte-americana Clinical Cancer Research e teve como base a dissertação de mestrado “Efeito do paclitaxel na via IRS/PI3K/ Akt/mTOR em linhagem de adenocarcinoma de mama e carcinoma de pulmão”, defendida no ano passado no programa de pós-graduação em fisiopatologia médica da FCM pelo biólogo Guilherme Zweig Rocha. A orientação do trabalho foi do professor do Departamento de Clínica Médica e médico oncologista José Barreto Campello Carvalheira. 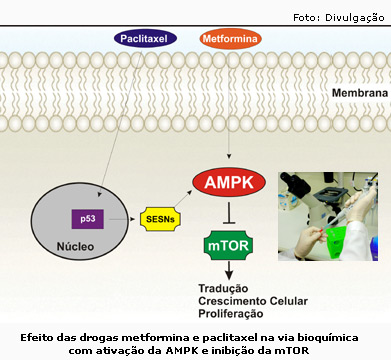 Em 1956, o Instituto Nacional do Câncer dos Estados Unidos estabeleceu um amplo programa para a coleta e teste da atividade anticâncer de plantas e algas marinhas. Este programa resultou na descoberta dos taxanos e das camptotecinas. O paclitaxel é um dos principais taxanos usados atualmente e cuja promoção de morte celular decorre de seus efeitos em microtúbulos. Inicialmente, o paclitaxel era difícil de ser sintetizado e virtualmente insolúvel, só tendo sido possível seu uso clínico a partir de 1991. O paclitaxel é um dos mais importantes quimioterápicos surgidos no final do século XX.
Em 1956, o Instituto Nacional do Câncer dos Estados Unidos estabeleceu um amplo programa para a coleta e teste da atividade anticâncer de plantas e algas marinhas. Este programa resultou na descoberta dos taxanos e das camptotecinas. O paclitaxel é um dos principais taxanos usados atualmente e cuja promoção de morte celular decorre de seus efeitos em microtúbulos. Inicialmente, o paclitaxel era difícil de ser sintetizado e virtualmente insolúvel, só tendo sido possível seu uso clínico a partir de 1991. O paclitaxel é um dos mais importantes quimioterápicos surgidos no final do século XX.